Command Palette
Search for a command to run...
剑桥大学研发血液细胞图像分类器,扩散模型助力白血病发现,能力超越临床专家

血液细胞影像分析在临床诊断和科研中扮演着至关重要的角色。白细胞、红细胞和血小板的形态特征不仅能反映血液系统健康状况,还可能揭示早期疾病信号,如白血病和骨髓增生异常综合征等。然而,传统人工显微镜分析依赖经验丰富的专家进行手动分类,效率低下、耗时且存在主观偏差。
近年来,深度学习技术在医学图像分析领域的应用日益广泛,已有研究尝试将判别模型,尤其是卷积神经网络(CNN)应用于血细胞形态评估。尽管性能最优的判别式 ML 分类模型在将细胞分类为预定义类别时可逼近人类表现,但它们主要学习基于专家标签的决策边界。因此,它们并非天然设计用于捕捉细胞形态的完整数据分布。这一限制会降低它们的能力,尤其是在面对临床血液学数据中固有的复杂性和变异性时。
在这一背景下,来自英国剑桥大学的研究团队提出了 CytoDiffusion——一种基于扩散模型的血液细胞图像分类方法。它能够忠实建模血细胞形态分布,实现精准分类,同时具备强大的异常检测能力、对分布偏移的抵抗力、可解释性、高数据效率,以及超越临床专家的不确定性量化能力。
该模型在异常检测(AUC:0.990 对比 0.916)、分布偏移下的鲁棒性(准确率:0.854 对比 0.738)以及低数据情境下的表现(平衡准确率:0.962 对比 0.924)方面均优于最先进的判别模型。该研究构建的全面评估框架为血液学医学图像分析设立了多维基准,有望在临床环境中提升诊断准确性。
相关研究成果以「Deep generative classification of blood cell morphology」为题,已刊登 Nature 。
研究亮点:
* 将潜在扩散模型应用于血细胞图像分类。
* 提出超越准确率等标准指标的评估框架,纳入分布偏移鲁棒性、异常检测能力和低数据情境下表现。
* 构建包含成像伪影及标注者置信度的新血细胞图像数据集,解决现有数据集的关键局限。

论文地址:
https://www.nature.com/articles/s42256-025-01122-7
关注公众号,后台回复「CytoDiffusion」获取完整 PDF
数据集地址:
更多 AI 前沿论文:
https://hyper.ai/papers
数据集:组合使用公开数据集和自主构建数据集
数据是血液细胞图像分析的基础,也是 AI 模型性能和泛化能力的核心保障。 CytoDiffusion 团队使用了五个数据集,其中四个公开可获取,另一个为自主构建的数据集 CytoData 。
CytoData 数据集是一个匿名数据集,包含来自剑桥 Addenbrooke’s 医院的 2,904 张血液涂片,共计 559,808 张单细胞图像,其中 4,996 张图像标注了十类血液细胞类型,包括红细胞母细胞、嗜酸性粒细胞、单核细胞、幼稚细胞等。图像由 CellaVision DM9600 系统采集,标注包括每位标注专家的置信度评分,为后续不确定性量化提供重要参考。 CytoData 还特别加入了伪影类别,以应对血液涂片中常见的非细胞结构干扰,这在临床应用中具有重要价值。
Raabin-WBC 、 PBC 、 Bodzas 、 LISC 作为 4 个公开数据集,涵盖不同显微镜、不同染色方法及不同设备下的血液细胞图像。 Raabin-WBC 提供了 Test-A 和 Test-B 划分,Test-B 的采集设备与训练集不同,用于模拟域偏移。 LISC 数据集因设备与染色方法差异,更加考验模型的泛化能力。
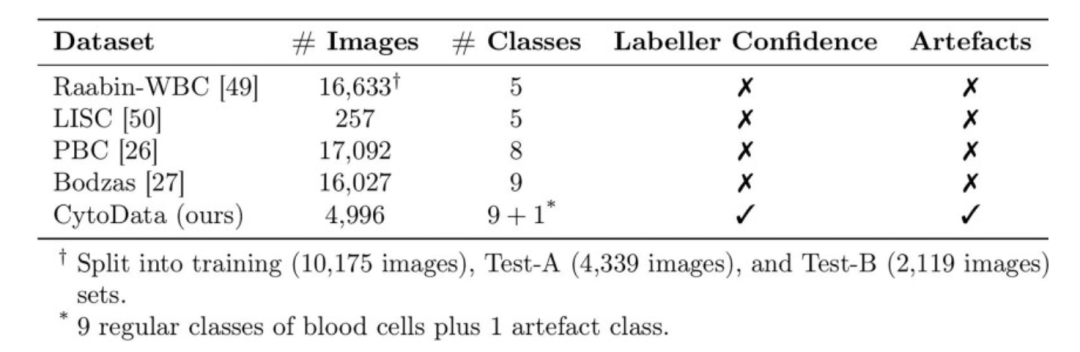
通过组合这些多源数据集,团队不仅保证了模型训练的多样性,也为跨域性能评估、异常细胞检测和数据稀缺条件下的模型测试提供了完整基础。
数据集地址:
框架:将扩散模型应用于血液细胞图像分类
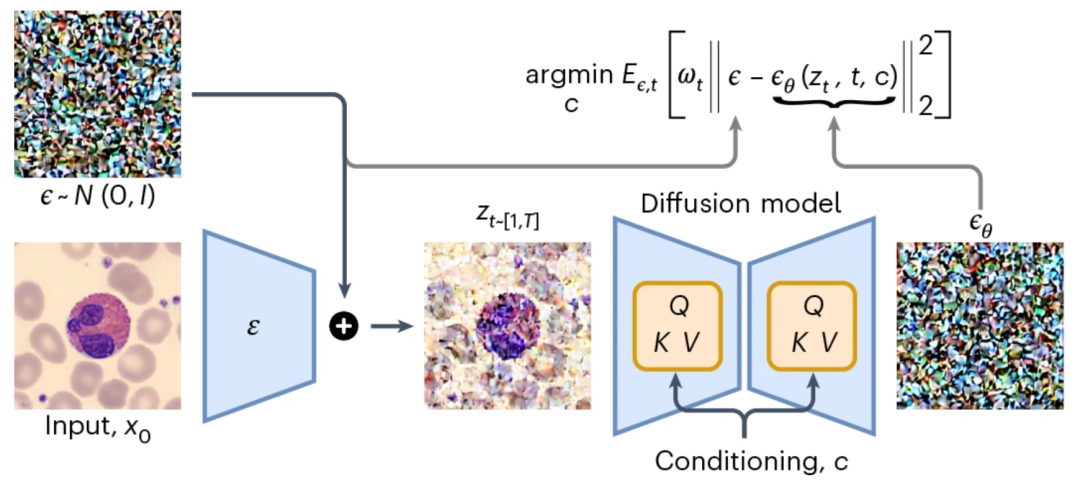
CytoDiffusion 的核心创新在于将扩散模型(diffusion model)应用于血液细胞图像分类。与传统判别式模型不同,扩散模型具有生成式特性,能够学习图像的完整分布,并通过噪声预测机制进行分类。
模型原理
扩散模型的核心原理是定义一个前向扩散过程,通过逐步向数据中添加噪声,将其转换为类似噪声的分布。随后,模型学习一个逆向过程来去噪数据,从而有效重建原始数据分布。
潜在空间编码:输入图像首先通过编码器映射到潜在空间,随后加入高斯噪声形成噪声潜在表示;
条件扩散:模型针对每一类细胞生成噪声预测,通过最小化预测噪声与真实噪声之间的误差实现分类;
逐步消除:对所有候选类别进行迭代采样,利用配对 Student’s t 检验逐步排除不可能类别,直至确定最终类别。
通用训练设置
研究人员使用 Stable Diffusion 1.5 作为基础模型。对于类别条件,其绕过了分词器和文本编码器,直接为每个类别提供 one-hot 编码向量,这些向量垂直复制,水平填充以匹配预期的 77 × 768 维矩阵。使用 10 的批量大小、 10⁻⁵ 的学习率,并进行了 1000 步的线性预热,训练平台为 A100-80GB GPU 。
训练和推理
研究人员在训练过程中应用了多种数据增强方法,包括随机对角翻转、随机旋转(角度在 0 至 359 度之间均匀采样)、颜色抖动(亮度 = 0.25 、对比度 = 0.25 、饱和度 = 0.25 、色相 = 0.125)、以及 Mixup(α = 0.3,作用于条件输入而非目标)和 RandAugment(使用默认参数)。
训练中使用 AdamW 优化器(β1 = 0.9,β2 = 0.999,ϵ = 10⁻⁸,权重衰减 0.01)、混合精度训练(fp16)以及指数移动平均(0.9999)。所有图像统一调整为 360 × 360 像素。
在推理阶段,应用了与训练阶段相同的数据增强方法,但排除了 Mixup 。利用白细胞通常位于图像中心的特点,并为减少对图像边缘区域增强造成的干扰,仅在潜在空间中距离图像中心半径为 20 的像素范围内计算推理误差。潜在空间维度为 45 × 45 × 4 。
成果展示:CytoDiffusion 可助力解决临床部署中的关键挑战
图像生成与真实性验证
临床采用人工智能系统不仅需要高性能,还要求模型具备可信的表征能力。为了证明 CytoDiffusion 学习到的是血细胞的真实形态分布,而非依赖伪影等 “捷径”,研究人员进行了真实性测试。
在 32,619 张训练图像基础上,CytoDiffusion 生成的血液细胞图像几乎无法与真实图像区分。十位血液学专家对 2,880 张图像进行鉴别测试,整体准确率 0.523(随机猜测水平),灵敏度 0.558,特异性 0.489 。该表现接近随机猜测,说明即使对经验丰富的专业人士而言,CytoDiffusion 生成的血细胞图像也几乎无法与真实图像区分。
能生成与真实图像几乎无差别的图像表明,说明 CytoDiffusion 已经成功学习到了血细胞形态的真实分布,如下图所示:
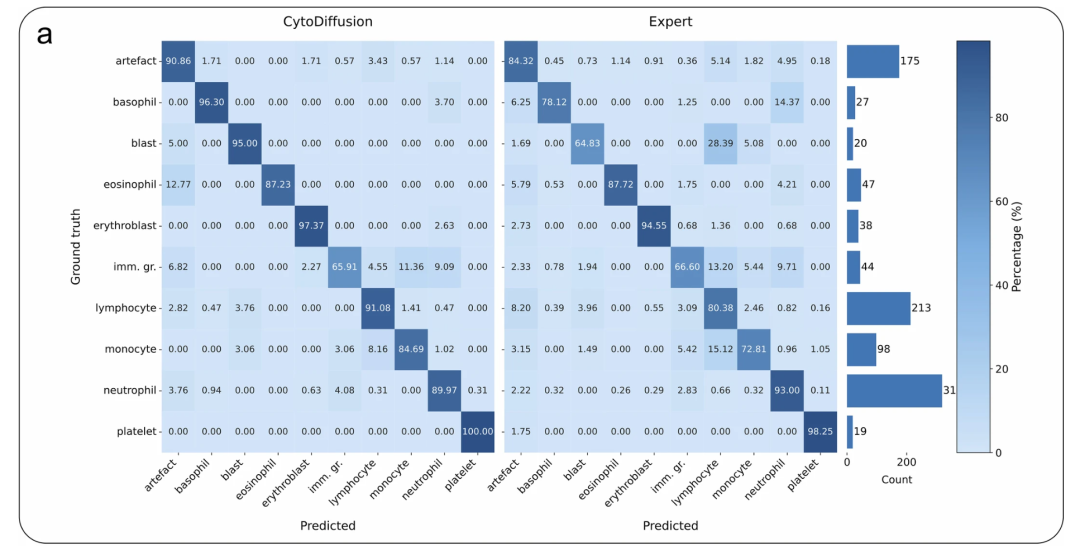
CytoData 对比:左侧矩阵显示 CytoDiffusion 的结果,右侧矩阵显示人类专家的平均性能
分类性能
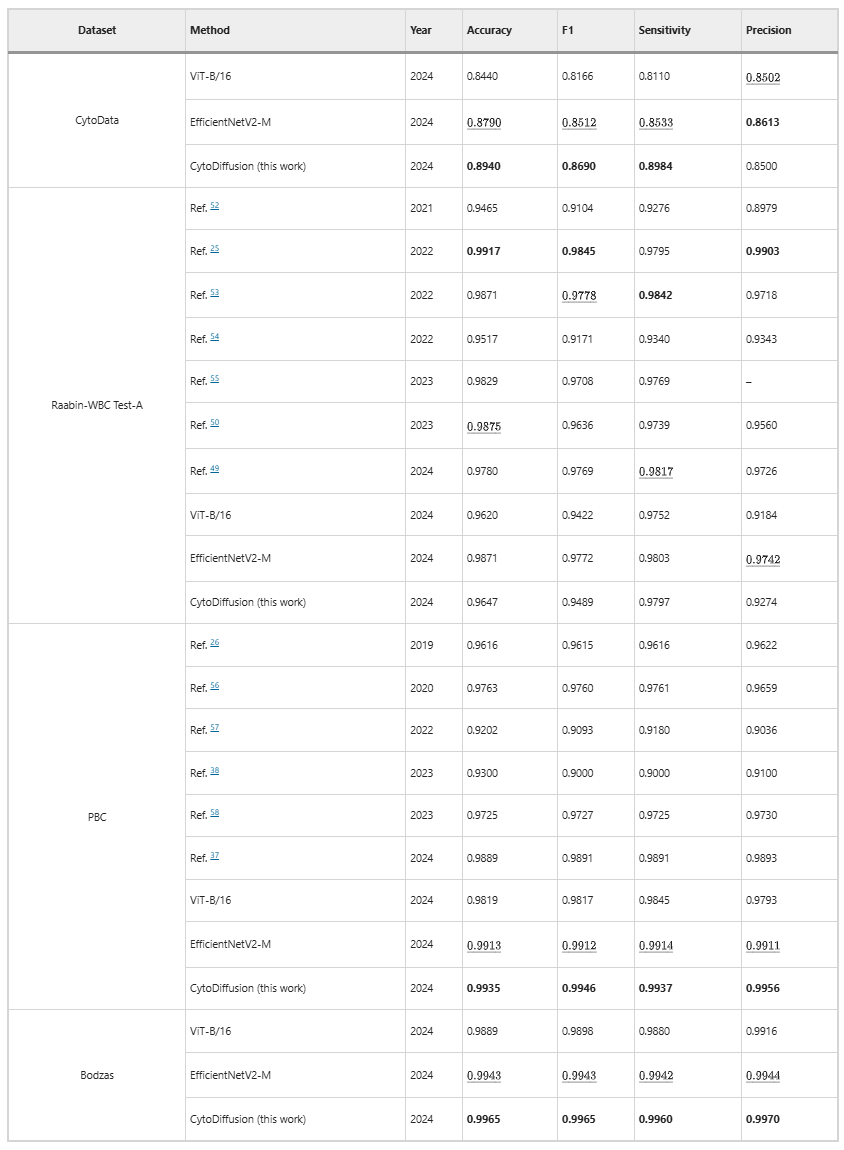
在 4 个数据集(CytoData 、 Raabin-WBC 、 PBC 、 Bodzas)上,CytoDiffusion 达到或超越传统判别式模型表现。尤其在 CytoData 、 PBC 与 Bodzas 上,模型均实现了当前最佳水平,证明基于扩散模型的方法能够匹敌或超越传统判别模型,如下表所示:
不确定性量化优于人类专家
生物系统本质上具有不可完全化约的固有不确定性。在任何分析任务中,衡量不仅是预测的正确性,还应衡量执行者(无论是人类还是机器)的不确定性。
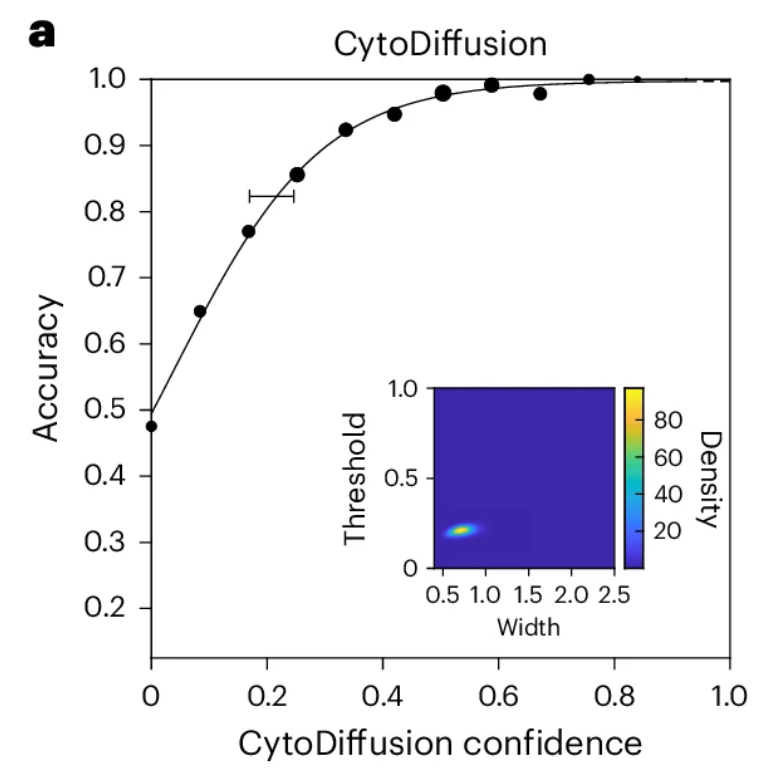
研究人员使用已建立的贝叶斯心理计量建模技术推导 CytoDiffusion 的心理计量函数,如下图,结果显示模型拟合优异,关键阈值与宽度参数的后验分布都非常紧致(下图内嵌坐标轴)。尽管无法直接测量,但这些结果表明 CytoDiffusion 的不确定性主要由偶然成分主导,其行为接近理想观察者的表现。
异常细胞检测与低数据环境表现
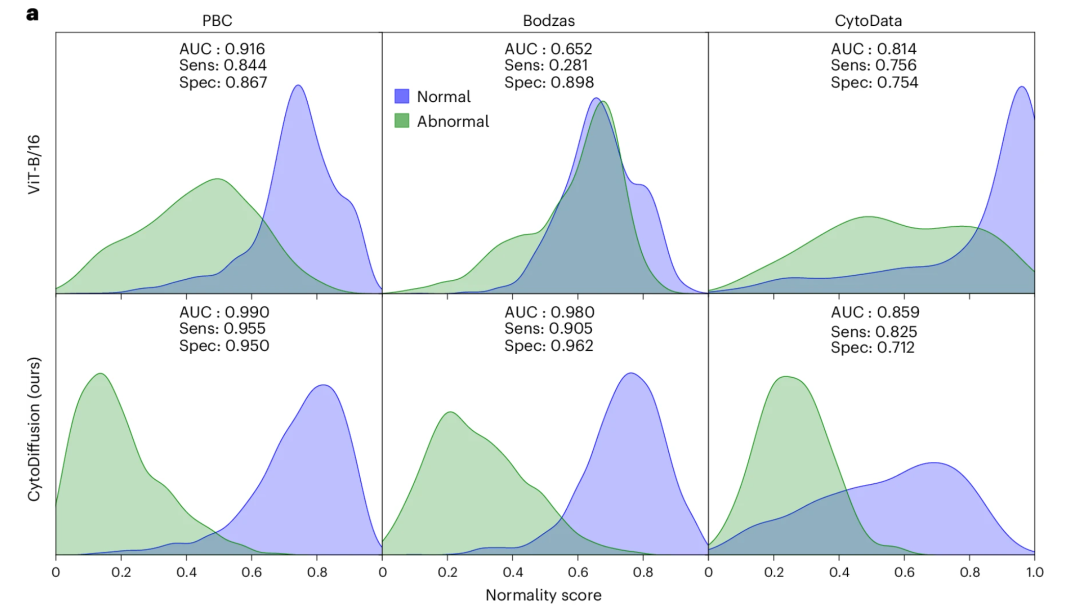
对于异常细胞检测,在 Bodzas 数据集中,以原始细胞作为异常类别时,CytoDiffusion 实现了高敏感性(0.905)和高特异性(0.962)。相比之下,ViT 的敏感性极低(0.281),明显无法满足临床应用需求,如下图:
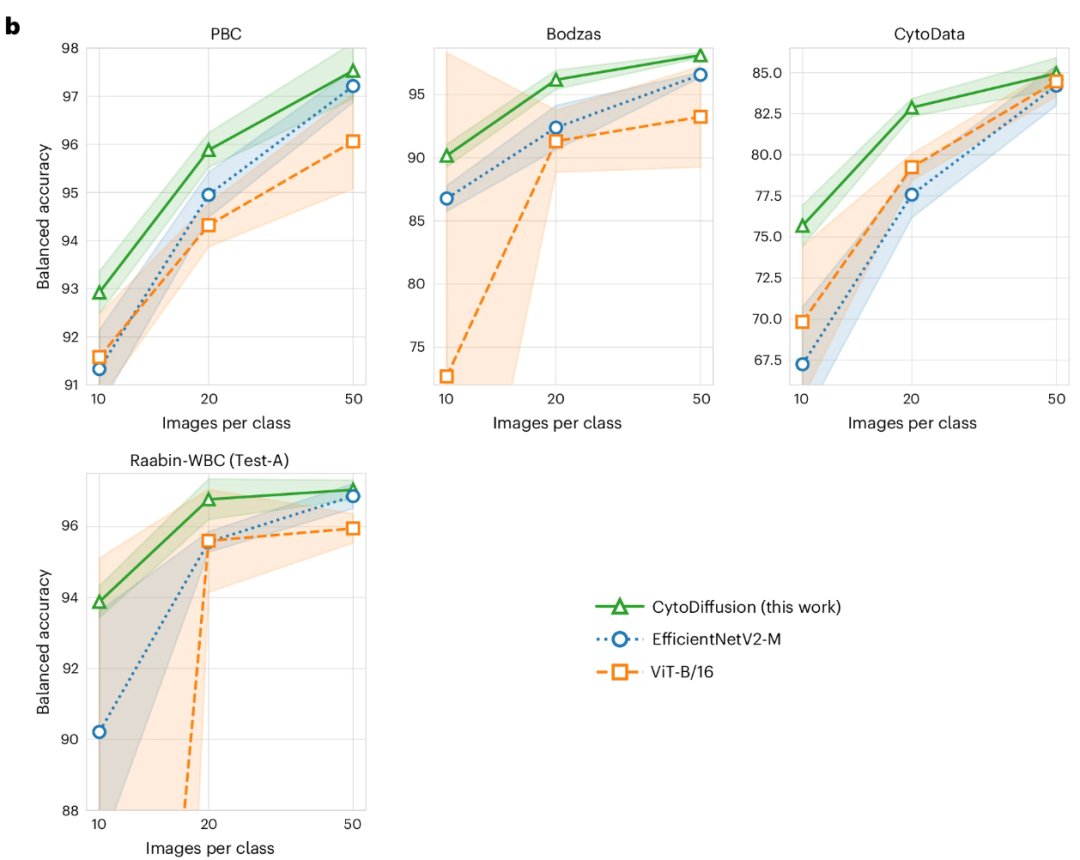
对于低数据环境,在每类仅 10–50 张训练图像情况下,CytoDiffusion 显著优于 EfficientNetV2-M 与 ViT-B/16,展示了数据稀缺条件下的高效学习能力,如下图:
模型泛化能力
为了评估模型的泛化能力,研究人员在不同数据域上测试了模型的表现。以 Raabin-WBC 训练的模型分别在 Test-B(使用不同显微镜和相机)和 LISC(不同显微镜、相机和染色)数据集上进行测试;以 CytoData 训练的模型则在 PBC 和 Bodzas 上进行测试。 CytoDiffusion 在这四个数据集上均实现了最先进的准确率。这种跨不同程度领域漂移的一致性优势表明,CytoDiffusion 对数据集变化具有鲁棒性,具备在真实临床场景中良好的泛化能力。
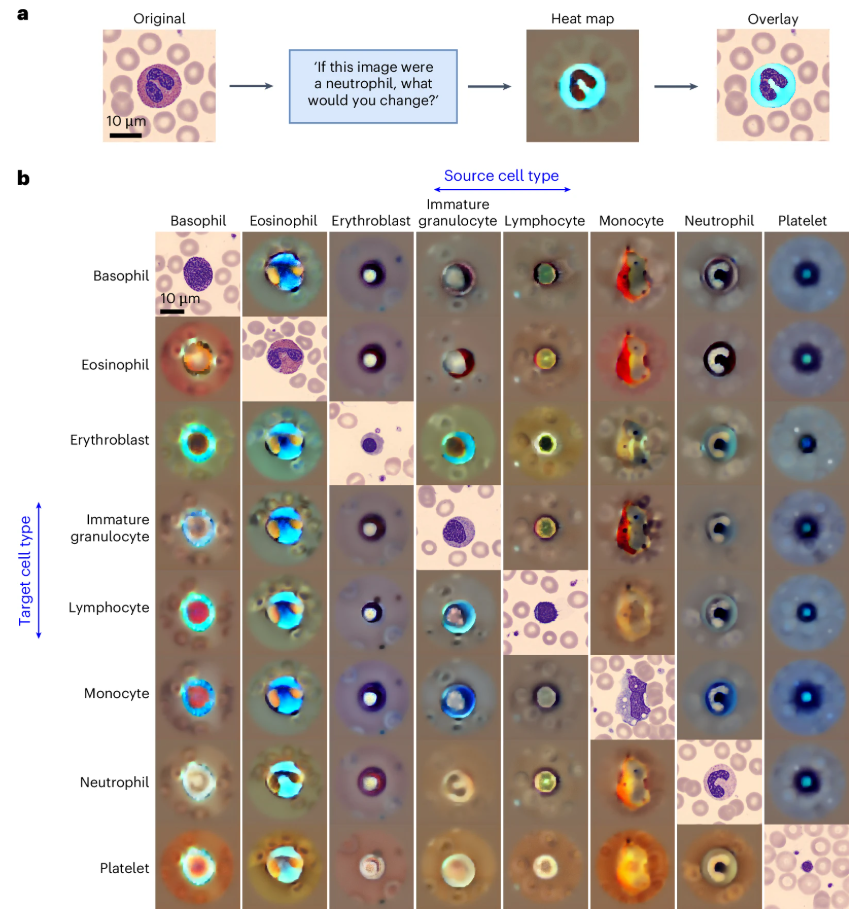
可解释性验证
通过反事实热图分析,模型能够识别细胞内部关键形态特征,如下图。例如,从单核细胞到未成熟粒细胞的转变中,模型突出显示了胞质酸性差异及液泡填充特征。这种可视化不仅验证了模型的学习能力,也可用于检测潜在偏差,确保分类依据符合临床科学逻辑。
扩散模型在生物医疗领域焕发突破性价值
CytoDiffusion 的研究不仅展示了扩散模型在血细胞形态学分类中的潜力,也映射出扩散式生成框架在整个生物医学领域的快速崛起,在多个应用场景中展现出突破性价值。
例如,医疗领域的数据通常较为有限且存在较大的隐私保护问题,这使得数据获取和标注成为巨大的挑战,扩散模型能够通过生成合成医疗图像来解决这一问题,从而帮助训练深度学习模型,并提高医学影像分析的精度;除了生成普通的医学图像,扩散模型还可以被应用于生成特定病症(如肿瘤、骨折等)的医学图像,这在训练医学诊断模型时尤其重要,能够为稀有病症或难以获取的影像提供更多的训练样本;同时,扩散模型能够生成高质量、清晰且具有真实感的图像,不仅有助于提高医生的诊断精度,还有助于辅助医疗 AI 系统做出更加准确的预测。
在许多临床和研究场景中,高质量医学影像数据集的稀缺阻碍了人工智能(AI)在临床应用中的潜力。 2024 年 12 月,温州医科大学附属眼视光医院张康教授及瞿佳教授、北京大学王劲卓研究员为通讯作者,北京大学王凯博士、中山大学孙逸仙纪念医院余运芳博士等为并列第一作者,研发了一种基于扩散模型的新型框架 MINIM,该模型能够基于文本指令生成不同器官的多种影像模式的医学图像。临床医生的评估和严格的客观测量验证了 MINIM 生成图像的高质量。当面对前所未见的数据领域时,MINIM 表现出增强的生成能力,展示了其作为通用医学 AI(GMAI)的潜力。
论文标题:Self-improving generative foundation model for synthetic medical image generation and clinical applications
论文地址:https://www.nature.com/articles/s41591-024-03359-y
在细胞生物学研究中,活细胞是远离化学平衡的复杂耗散系统,其群体如何协同响应外界刺激,始终是科学家致力揭示的核心科学问题。 2025 年 11 月,来自哥伦比亚大学、斯坦福大学等研究团队,开发了 Squidiff 计算框架。该框架基于条件去噪扩散隐式模型构建,可预测不同细胞类型在分化诱导、基因扰动及药物处理下的转录组响应。其核心优势在于能整合基因编辑工具与药物化合物的明确信息:在预测干细胞分化过程中,不仅能精准捕捉瞬时细胞状态,还可识别非加性基因扰动效应及细胞特异性响应特征。研究团队进一步将 Squidiff 应用于血管类器官研究,成功预测了辐射暴露对各类细胞的影响效应,并评估了辐射防护药物的保护效能。
论文标题:Squidiff: predicting cellular development and responses to perturbations using a diffusion model
论文地址:https://www.nature.com/articles/s41592-025-02877-y
可以预见,随着生成式基础模型在医学领域进一步成熟,扩散模型将在更多真实临床场景中落地,成为通用医学智能的重要底座,为未来的医学影像诊断、疾病预测与智能决策带来更高的可靠性、更强的泛化能力与更广的应用空间。
参考文献:
1.https://www.nature.com/articles/s42256-025-01122-7
2.https://www.nature.com/articles/s41592-025-02877-y
3.https://mp.weixin.qq.com/s/9JEt-QwFxngv9XC0hSIcnw
4.https://bbs.huaweicloud.com/blogs/448218








